Kann das Elektron Energieniveaus überspringen?
Wenn einem Atom die Energie E = E4 – E1 zugeführt wird,
springt das Elektron gleich von Schale 1 auf Schale 4 und überspringt die Schalen dazwischen, oder kann das Elektron nur auf die nächsthöhere Schale (von Schale 1 auf Schale 2 bzw. E = E2 – E1) ?
Mit anderen Worten: Was passiert, wenn dem Atom die Energie E = E4 – E1 zugeführt wird?
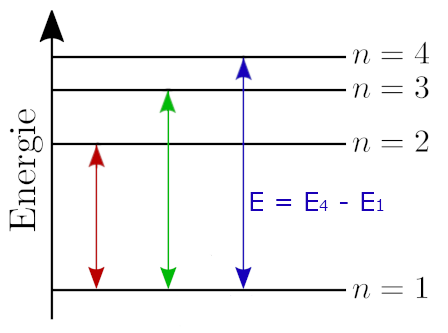
Klar, das Elektron kann in ein beliebiges Energieniveau springen, wo noch Platz ist, nicht nur in ein benachbartes. Das ist sogar eher die Regel als die Ausnahme, weil benachbarte Niveaus meist schon voll besetzt sind (außer es geht um ein Elektron in der äußersten Schale).
Die Anregungen aufbringen höheres Niveau ist durchaus möglich (siehe Jablonski Diagramm). Je nachdem auf welches S-Niveau angeregt wird, hast du unterschiedliche Anregungs oder Absorptionsspektren. Dies ist vorallem für die Fluoreszenzspektroskopie oder ähnlichen Methoden wichtig, da die die Niveaus und resultierenden Werte Aufschluss über Entfernung benachbarter markierter Moleküle und Größen geben.
vielleicht sollte man dazu anmerken das Elektronen, alle Kernbausteine, keine Partikel sind, sondern Wellen, deswegen sind solche Annahmen nur hypothetisch.
Hab das was dazu, unter https://mfe.webhop.me/astronomie-physik/energie/wie-elektronen-sich-aus-dem-weg-gehen/ gibt es eine Spannende Betrachtung dazu.